Россия появилась на мировой карте клинических исследований сравнительно поздно, быстро заняла на рынке приличные позиции, но в последние годы планомерно их теряет. Сейчас исследований у нас проводится, в расчете на миллион населения, в несколько раз меньше, чем в большинстве развитых стран. Российское население так старательно защищают от опасностей, связанных с КИ и новыми препаратами, что компании‑разработчики, не сумев преодолеть защитные бастионы, одна за другой уходят проводить исследования и регистрировать новые препараты в более удобные для этого страны. Спасают российский рынок КИ скудные возможности бесплатной медицины, точнее – недоступность для большинства населения инновационной терапии. Для многих пациентов участие в исследовании оказывается единственной возможностью получить хорошее современное лечение. Поэтому недостатка в испытуемых у исследователей в России нет.
В судьбе клинического исследования возможны всякие повороты. Перспективные лекарства оказываются непригодными в тот самый момент, когда все ждут последнего подтверждения блестящих результатов (пример – в материале «Невыносимая легкость забытия»). Безобидные вроде бы разработки приводят к трагедиям. Или напротив, у препаратов, на которые все махнули рукой, обнаруживаются ценные терапевтические свойства. Особенность нашей страны в том, что неожиданности и проблемы в сфере КИ она нередко создает себе сама.В прошлом году известная фармацевтическая компания решила для упрощения логистики разделить российскую часть большого международного многоцентрового исследования на две части, рассказывает сотрудница CRO (contract research organization, подрядчик в проведении «клиники»). Части были идентичны по исследуемому препарату, дизайну исследования, протоколам. Но Минздрав разрешил только одну половину испытания, а ее сестре-близнецу выдал длинный список замечаний и запросил дополнительную информацию. Вскоре во всех выбранных для исследования странах работы начались, а в России компания еще долго собирала дополнительные документы.

Фото: innogest.ru
Бывают неожиданности и противоположного толка. В январе этого года Владимир Путин заявил, что в России создана и зарегистрирована вакцина против геморрагической лихорадки Эбола. Вскоре Вероника Скворцова пояснила, что вакцин даже две и обе созданы в НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи. За последние 15 лет у нас был зафиксирован всего один случай заболевания, но вакцину засекретили. Однако документы о клинических исследованиях остались в открытом доступе. Из них следует, что разрешение на проведение КИ вакцина получила ровно за сутки, в 90 раз быстрее, чем в среднем по отрасли.
ПОНИЖЕННАЯ ПРОВОДИМОСТЬ
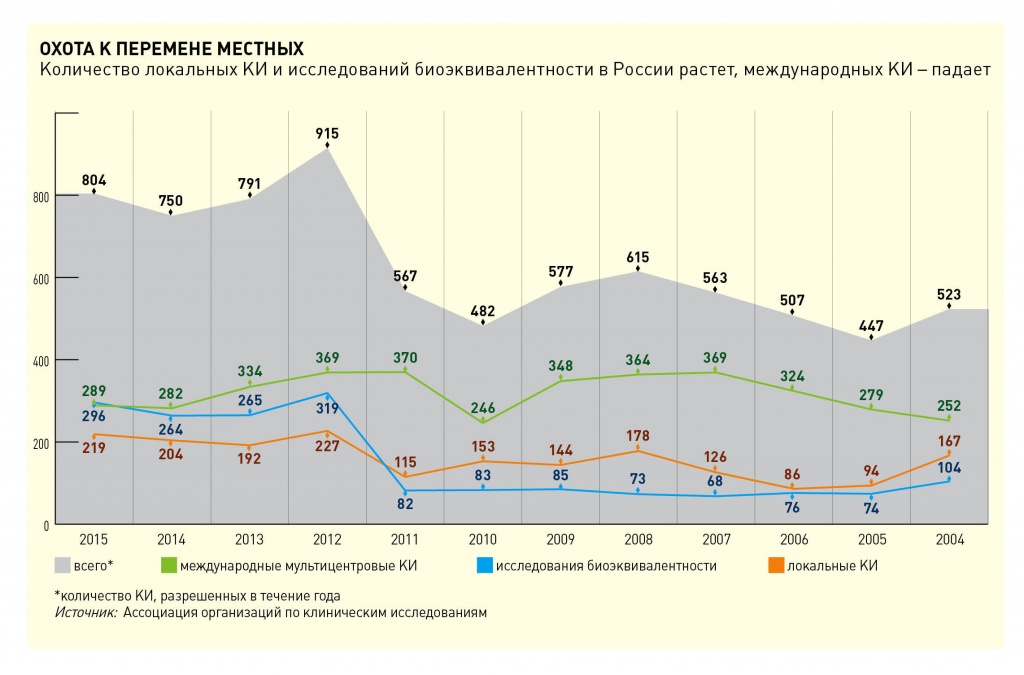
Фармацевтические компании и исследовательские фирмы-подрядчики в один голос говорят, что в принципе наша страна – одна из лучших для проведения любой фазы «клиники». Но статистика этого не подтверждает. По данным Ассоциации организаций клинических исследований (АОКИ), в прошлом году Минздрав РФ выдал 804 разрешения на проведение КИ. Тенденции к росту в последние годы нет: в 2014 году было 750 разрешений, в 2013-м – 793, в 2012-м – 915. Активность страны в этой сфере принято оценивать по количеству исследований на миллион жителей. Если не учитывать исследования биоэквивалентности, в России на миллион человек сейчас приходится 3,5 КИ в год, в Польше – чуть больше 10, в Германии – 30,6, в Великобритании – 38,9, в США – 55,1, во Франции – 57.Впрочем, для рынка важно не только количество, но и вид проводимых исследований. Можно с определенной натяжкой сказать, что международные многоцентровые исследования (ММКИ) – классика жанра. Такие испытания ведутся одновременно во многих странах, по единым стандартам, по одной и той же схеме. Их выборочно проверяет FDA или, если речь идет о европейской компании, его европейский аналог – EMA (European Medicines Agency). Локальные КИ – это главным образом исследования дженериков. Обычно дело ограничивается проверкой их биоэквивалентности: исследователи должны убедиться, что препарат-копия и оригинал с одинаковой скоростью всасываются в кровь, достигают одинаковой концентрации, одинаково распределяются по тканям. Проверкой локальных исследований у нас занимается Росздравнадзор. В последнее время качество этих проверок сильно выросло, констатируют участники рынка, но еще несколько лет назад ведомство в основном проверяло не соответствие исследования строгим нормам, а то, не используются ли незаконным образом для его проведения государственные средства. Среди локальных КИ есть также группа исследований, к которым большинство опрошенных Vademecum участников рынка относятся скорее как к досадной формальности. Это КИ препаратов, которые в мире уже продаются, но в России еще не зарегистрированы. С 2010 года, в соответствии с нормами 61-ФЗ «Об обращении лекарственных средств», иностранных КИ для регистрации препарата в РФ недостаточно, пусть даже они охватывали десятки стран. «Мы пытаемся бороться за отмену этого требования, – говорит исполнительный директор АОКИ Светлана Завидова, – но результатов пока нет».
Как соотносятся КИ разных типов в России? В 2011 году было выдано 370 разрешений на ММКИ, их доля в общем объеме удовлетворенных заявок достигла 63%, да и в предшествующие годы ни разу не падала ниже 50%. В 2015 году на ММКИ пришлось лишь 36% выданных разрешений. Главная причина снижения интереса международных компаний к российскому рынку, считают представители CRO, – в сложности согласовательных процедур. Сам Минздрав экспертизой заявок на проведение КИ не занимается, документы попадают в Совет по этике и ФГБУ «Научный центр экспертизы средств медицинского применения» (НЦЭСМП). Роль министерства откровенно формальная. «Не было случаев, чтобы Совет по этике и НЦЭСМП выдали положительные заключения, а Минздрав запретил проведение этого КИ. Равно как и не было случаев, чтобы СЭ и/или НЦЭСМП выдали отрицательные заключения, а Минздрав разрешил КИ», – признал Vademecum НЦЭСМП.
«Когда к нам приезжают заказчики из-за рубежа, их первое желание – пойти проконсультироваться с регулирующими органами, чтобы понять, как у нас устроен процесс получения разрешений, какие правила нужно соблюдать», – рассказывает директор по клиническим операциям одной из CRO. Иностранцев приходится разочаровать: эксперты НЦЭСМП ни в какие контакты не вступают. Причем раньше консультироваться с ними было можно, но в прошлом году поправкой к 61-ФЗ эту практику, от греха подальше, пресекли. В США подобные консультации с регулятором – в порядке вещей. Не далее как в июне директор медицинского департамента «Р-Фарм» Михаил Самсонов на одной из отраслевых конференций сделал целую презентацию о том, как строится подобная практика с FDA. Это платная процедура, которая начинается по инициативе компаний и длится два месяца. С FDA можно обсудить предполагаемые дозы, критерии эффективности, выбор препаратов для сравнения и прочие весьма принципиальные вопросы. Эксперты агентства отвечают на вопросы – сначала письменно, а затем во время часовой очной встречи с представителями компании дают дополнительные разъяснения.
Портрет российского эксперта в сфере КИ компании могут составить только по его решениям. А решения эти, по мнению членов АОКИ, порой чрезвычайно странны. Ассоциация составила длинный список случаев, когда имели место немотивированные, по оценке компаний, отказы и придирки. Характерно, что имена недоумевающих и обескураженных заявителей ни в одном из эпизодов все-таки не называются: компании не хотят портить отношения с таинственными экспертами. Среди требований регулятора, приводит пример несуразности АОКИ, может встретиться и такое – предоставить список всех центров во всех странах, где будет проходить ММКИ. Это невозможно, объясняет Завидова, потому что подготовка к ММКИ идет одновременно во всех странах, и до начала исследования нельзя сказать, какие центры точно примут в нем участие. Встречается в списке и еще более необычное требование – «уменьшить количество центров для проведения исследования в России». Это не входит в компетенцию экспертов, утверждают в ассоциации. НЦЭСМП сообщил Vademecum, что не будет комментировать «вырванные из контекста» претензии. По статистике центра, доля отказов в регистрации с января 2015 года по июнь нынешнего составила 12%, а по ММКИ доля отрицательных заключений в I квартале 2016 года снизилась до 3,6%.
Но такой маленький процент отказов не означает, что все остальные исследования легко прошли экспертизу: по статистике АОКИ, примерно в трети случаев эксперты выдают замечания, требуют дополнительные документы, и процесс затягивается. «Каков же результат? – размышляет собеседник Vademecum в одной из оперирующих в России CRO. – Заказчик исследования рассчитывал получить разрешение к определенному сроку. Раз не получилось, еще раз. А медицинские центры в других странах уже набирают пациентов. Болгария, Румыния рванули – там такие же голодные врачи и пациенты. И в следующий раз заказчик вместо России может выбрать, вы не поверите, даже Грузию. Там население всего 4,5 млн, труднее найти пациентов с заданными параметрами, зато исследование стартует за два месяца, а не за полгода, из которых три месяца уходит на Минздрав». Вторая экспертная организация, Совет по этике, создает дополнительные трудности для исследователей в основном лишь при КИ на детях. Скажем, приводит пример собеседник Vademecum, требует разделить детей на две группы по возрасту и сначала испытать препарат на более старших, «хотя ни в одной другой стране такое требование не выдвигалось».

Фото: ТАСС
О ПОЛЬЗЕ БЕДНОСТИ
По мировым меркам российский рынок клинических испытаний очень молод. Постепенное включение российских исследований в систему ММКИ началось в середине 90-х. Тогда в Россию начали приходить представители мира CRO. В первых рядах здесь появилась Quintiles – одна из крупнейших мировых исследовательских организаций. Одновременно начали рождаться местные игроки – в частности, компания PSI, созданная несколькими выпускниками петербургских медицинских вузов при участии бельгийского инвестора, а сейчас превратившаяся в достаточно крупного международного исследователя. Нынешний гендиректор PSI Станислав Никитин 15 лет назад начал работу в сфере КИ с должности монитора – сотрудника исследовательской организации, который следит за тем, чтобы медицинские центры четко соблюдали все правила «клиники».«Рынок тогда был практически пустой, – вспоминает Никитин, – проводились единичные исследования, в основном локальные. У большинства врачей не было никакого опыта в сфере КИ, приходилось буквально вести их за руку». Только в онкологии, по словам Никитина, можно было найти специалистов с хорошим опытом международных исследований. Остальные начинали практически с нуля. «Протокол исследования – жесткий документ. Но у нас и в Восточной Европе врачи в этом смысле не очень дисциплинированные, могут лечить не по стандартам. А историю болезни так пишут, что про это анекдоты рассказывают», – говорит Никитин.
ММКИ быстро завоевывали рынок, уже в 2006 году было выдано 324 разрешения на их проведение (подробнее – в таблице «Охота к перемене местных»).
При этом врачи с опытом и именем, только-только превратившиеся в исследователей, вполне могли задать монитору вопрос вроде такого: «А кто нам предоставит первичную документацию?» Хотя именно они и должны эту документацию создавать. Неосвоенный и диковатый рынок оказался очень привлекательным прежде всего благодаря пациентам. Каким образом гражданин становится участником КИ? В США к этому пациентов довольно навязчиво призывает реклама. А на сайте clinicaltrials.gov, созданном американским Национальным институтом здоровья, можно найти все исследования, набирающие пациентов, посмотреть критерии включения и контакты центров, проводящих отбор. В России сложнее, но найти исследование все-таки можно, считают в АОКИ. Прежде всего надо просмотреть на минздравовском сайте разрешенных КИ все испытания, получившие разрешение в последние месяцы, – возможность искать по заболеваниям не предоставляется. Узнать же о критериях включения можно, найдя это же исследование на clinicaltrials.gov (правда, там представлены не все российские КИ). Потом надо вернуться на российский сайт, посмотреть список центров, ведущих это КИ, и связаться с одним из них. Пациент без знания английского споткнется на втором этапе. Корреспондент Vademecum не преодолел третий: дозвониться в течение суток не удалось, а письмо на clinicaltrials.gov с просьбой предоставить другие контакты осталось без ответа.
Стандартный для России способ поиска испытуемых – через лечащих врачей. Участие в КИ, прежде всего в самом его массовом III этапе, – это способ бесплатно получить доступ к передовому и, возможно, дорогостоящему лечению. В виде бонуса участник имеет более-менее регулярный контроль за состоянием своего здоровья. При участии в плацебо-контролируемых исследованиях есть риск попасть в группу принимающих пустышку. Но поддерживающая терапия будет в любом случае, а кроме того, аргументирует представитель крупной CRO, плацебо обычно используется в коротких исследованиях, в длительных же чаще применяется препарат контроля – уже существующее лекарство от той же болезни.
Денег за участие пациенты не получают. Исключение составляет, и то не всегда, I этап КИ, когда на здоровых добровольцах проверяется прежде всего безопасность препарата. И суммы здесь отнюдь не копеечные. Сотрудница CRO, просившая себя не называть, приводит пример: ее компания заплатила студентам-добровольцам за исследование, предусматривающее четыре визита в больницу, по 36 тысяч рублей. Первый и последний визиты были совсем короткими – вначале надо было подписать информированное согласие и обсудить планы, в конце – рассказать, были ли осложнения. А два визита с приемом препаратов стоили по 17 тысяч рублей: «Дорого, потому что добровольцы должны были оставаться в больнице целый день и подвергаться ряду процедур». На плате добровольцам сказывается в первую очередь количество и продолжительность приемов. В чуть меньшей степени – изученность препарата, который будут на них испытывать. По международным меркам услуги российских добровольцев стоят недорого. В Британии, говорит сотрудница CRO, многие клиники специально ориентированы на I фазу и имеют обширные базы студентов, которым «нередко платят и 2, и 2,5 тысячи фунтов за исследование». Во Франции законодательно определен «потолок», выше которого вознаграждение за одно исследование подниматься не может. Максимальная сумма показательна – 4,5 тысячи евро.
ЛОГИСТИЧЕСКИЙ ПАРАДОКС
Вообще, привлекательности России как базы для КИ способствуют ее же, России, проблемы. В канун кризиса 2014 года себестоимость российских КИ практически сравнялась с западноевропейской. Но падение рубля помогло бизнесу CRO: в сфере ММКИ принято учитывать расходы в долларах или евро независимо от того, какая валюта в реальности использовалась. В результате выплаты врачам и расходы на логистику в долларовом эквиваленте резко упали. И все же сейчас если проведение ММКИ в России и дешевле, чем на Западе, то не очень существенно, говорит руководитель клинических операций международной CRO-организации. Плата медицинским центрам и специалистам, прикидывает он, может быть в России на 15–20% ниже, скажем, германского уровня, «но бывают КИ, когда цены у нас и в Европе одинаковые». Другое дело, что российская логистика может оказаться даже дороже западной – за счет больших расстояний и таможенных проблем. «Однодневная поездка монитора, скажем, в Хабаровск обходится нам в 700 евро без учета его зарплаты», – говорит сотрудница CRO-компании. А доставка в Челябинск одной коробки с препаратом, требующим «холодовой цепочки», стоит примерно 1 тысячу евро, притом что авиадоставка «при комнатной температуре» обойдется максимум в 100 евро.Исследуемые препараты, в отличие от Европы, у нас облагаются 10%-ной таможенной пошлиной. Во многих международных исследованиях все лабораторные анализы, ради единообразия данных, проводятся в одном месте – например, в одной из европейских стран. Вывоз биообразцов требует специальных разрешений, часть которых приходится периодически обновлять. Несколько лет назад, вспоминает Завидова, международные исследования просто встали на несколько недель. Власти, испугавшись, по рассказам осведомленных источников, «вывоза генофонда», в принципе остановили вывоз биообразцов. Бессмысленный запрет вскоре отменили, но ощущение нестабильности российского рынка, которое и так есть у операторов КИ, только усилилось.
Фото: corporatecomplianceinsights.com
Из чего складывается цена исследования? Бюджет КИ чаще зависит не от числа пациентов, а от количества задействованных центров. Короткое одноцентровое исследование в Москве может стоить 100 тысяч евро – это, по мнению исследователей, минимум, если говорить о ММКИ, проводимых подрядчиком, а не самим производителем. Верхнюю границу назвать невозможно. Распространено мнение, что цена КИ в значительной степени определяется расходами на ведущих исследование специалистов. И хотя для врачей это действительно неплохой приработок, в процентном отношении им обычно достается немного. Сотрудница CRO на условиях анонимности раскрыла для Vademecum структуру затрат заказчика на одно сравнительно небольшое исследование.
Многоцентровой проект шел два года – шесть месяцев на получение разрешений, год на набор пациентов и собственно исследование, остальное время – на обработку данных. Заказчик заплатил подрядчику в общей сложности $500 тысяч. В $97 тысяч обошлись доставка и хранение препарата на складах – высокая цена объясняется необходимостью «холодовой цепочки». Дорого, $100 тысяч, стоили расходные материалы: когда анализы делает иностранная лаборатория, все необходимое для взятия и доставки образцов обычно тоже привозится из-за границы. Последняя из крупных трат заказчика – $170 тысяч, полученных контрактной организацией за проведение исследования. $32 тысячи стоил мониторинг, и всего $17 тысяч, поскольку пациентов было немного, досталось медицинским центрам и врачам. Компании, проводящие исследование, обычно все-таки находят возможность часть денег (как правило, не больше половины) выплатить непосредственно врачам. Ведь из денег, перечисленных медучреждению, аргументируют CRO, самим исследователям может достаться слишком мало. Впрочем, некоторые медорганизации ставят жесткое условие: «Все деньги только через нас». Такой политики придерживается, например, по отзывам CRO, Северо-Западный медицинский университет им. И.И. Мечникова.
Врачам, как правило, отдельно за «привод» пациента не платят: их гонорар определяется количеством приемов и списком процедур. Гонорар за одного пациента при длительном исследовании онкологического препарата, предполагающем много разнообразных анализов, может составить несколько тысяч евро. Обычно речь идет о нескольких больных и целой группе врачей, деньги между которыми распределяются в зависимости от коэффициента трудового участия.
ДОКТОР ЭБОЛИТ
Операторы КИ отмечают, что в регулировании этой сферы в России в последнее время происходят положительные изменения. Надзорные органы начинают действовать более профессионально, набираются опыта эксперты. Правда, сроки выдачи разрешений не сокращаются. Только на то, чтобы забрать из Минздрава разрешение (уже после того, как становится известно о его готовности), у заявителя уходит примерно три недели. А ведь отдельные разрешения нужно получать еще и на ввоз экспериментальных препаратов. Не воспользоваться ли Минздраву собственным опытом экспресс-регистрации КИ для вакцины от Эболы?Рассмотрим эту историю исключительно с точки зрения «клиники» и оборота соответствующей документации. Конкурс на проведение КИ был объявлен 17 августа 2015 года с начальной суммой контракта 19,55 млн рублей. Конверты с предложениями участников были вскрыты 31 августа: заявки подали ООО «Био-Эк», Гематологический научный центр Минздрава и Военно-медицинская академия им. С.М. Кирова. Последняя и была признана победителем, соответствующий договор с ВМА датирован 10 сентября 2015 года. В тот же день, судя по документам о приемке работ, начался I этап исследования, 6 октября без перерыва сменившийся II этапом. Заказчик «клиники», НИИ им. Н.Ф. Гамалеи, отказался обсуждать с Vademecum тему Эболы, запросы в ВМА и Минобороны РФ (академия подчиняется военному ведомству) остались без ответа. Если действовать по правилам, такая ситуация невозможна в принципе, оценивают экспресс-испытание вакцины от Эболы участники рынка: НИИ им. Гамалеи, как заказчик, не мог получить разрешение на проведение КИ заранее, потому что заявку на КИ подают обязательно с указанием конкретного исполнителя. Поменять испытателя по времени почти то же самое, что пройти все этапы заново.
Акт о приемке выполненных работ по КИ стороны подписали 31 декабря 2015 года. А Минздрав сыграл на опережение – 28 декабря обе вакцины зарегистрировали, не дождавшись ни II-III фаз, ни даже полного подведения итогов I фазы. Как же удалось ВМА в течение одного трудного дня, 10 сентября 2015 года, не только получить разрешение, но и найти 92 здоровых добровольца? А вот в этом, считают на рынке, как раз ничего невозможного не было. С учетом гонорара в 110 тысяч рублей на каждого.






